الوقاية الوراثية من ارتفاع الحرارة الخبيث
الوحدة PRV07
يعد ارتفاع الحرارة الخبيث (مضاعفات التخدير) من مضاعفات التخدير النادرة، ولكنها قد تهدد الحياة. يتم تحفيزه بواسطة بعض أدوية التخدير القياسية. إذا كان الشخص الذي يطلب المشورة يعرف عن استعداده للإصابة بارتفاع الحرارة الخبيث، فإن الطبيب المعالج يعرف نوع المخدر الآمن الذي يجب استخدامه في حالة إجراء عملية جراحية.
ما هو ارتفاع الحرارة الخبيث؟
ارتفاع الحرارة الخبيث هو أحد المضاعفات التي تهدد الحياة أثناء التخدير. في حالة وجود متغيرات (تغيرات) وراثية ذات صلة، فإن إعطاء بعض أدوية التخدير القياسية أو مرخيات العضلات يمكن أن يؤدي إلى فقدان السيطرة على استقلاب الكالسيوم في العضلات.
العضلات هي المسؤولة عن جميع تسلسلات الحركة في الجسم. وهذا لا يشمل حركاتنا الواعية فحسب، بل يشمل أيضًا، على سبيل المثال، تمدد الرئتين عند التنفس وعضلات القلب.
تتكون العضلات من حزم تحتوي على عدة ألياف عضلية. تتكون هذه الألياف العضلية من خلايا يمكنها، اعتمادًا على الحركة المطلوبة، أن تتقلص أو تتوسع (الشكل 1). إذا وصلت إشارة الحركة، وهي نبضة عصبية، إلى العضلات، يتم إطلاق الكالسيوم. يضمن الكالسيوم انزلاق خيطين، الأكتين والميوسين، إلى بعضهما البعض في الخلية العضلية، مما يؤدي إلى تقلص العضلات.
بالنسبة لبعض المتغيرات في جين مستقبل الكالسيوم، يتم إطلاق الكالسيوم بشكل دائم من خلال أدوية التخدير المستخدمة. وهذا يؤدي إلى تشنج العضلات حتى تصلب العضلات وزيادة قوية في ضغط الدم ودرجة حرارة الجسم. إذا لم يتم علاج الأعراض بسرعة كبيرة، فقد تحدث الوفاة بسبب فشل التمثيل الغذائي والأعضاء.
يتم التعرف على ارتفاع الحرارة الخبيث في الغالب فقط في حالة وجود مضاعفات تهدد الحياة بعد تناول المخدرات أو مرخيات العضلات أثناء الجراحة. ومع ذلك، حتى التخدير الجيد التحمل لا يستبعد الاستعداد للإصابة بارتفاع الحرارة الخبيث، حيث أن المرضى نجوا في المتوسط من ثلاثة تخدير دون مشاكل قبل حدوث هذه المضاعفات.
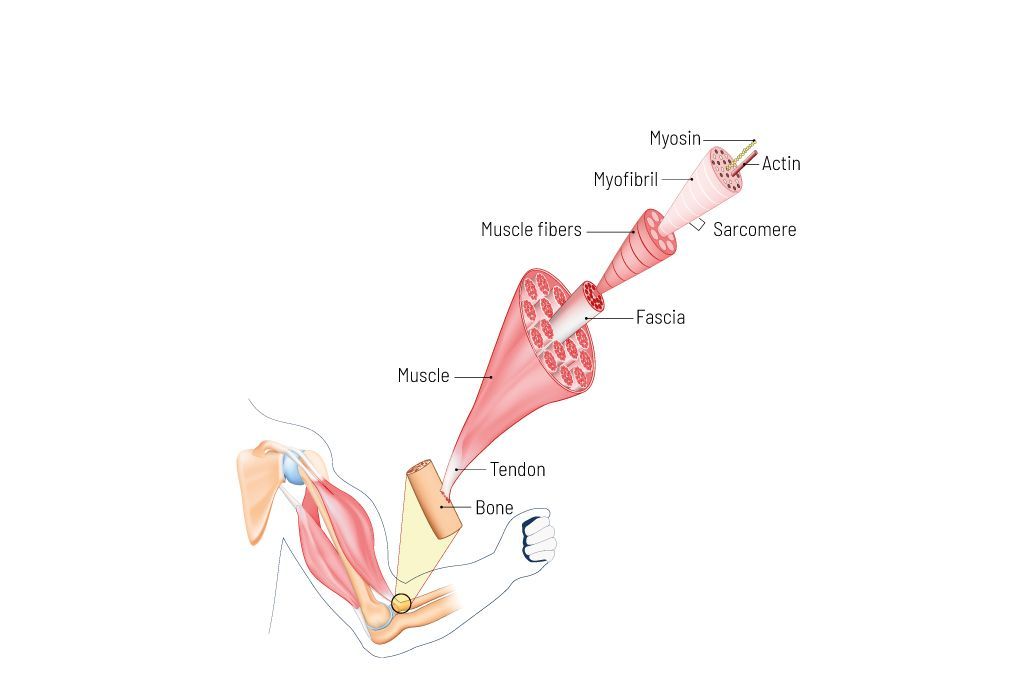
الشكل 1: هيكل العضلات الهيكلية. القسيم العضلي هو أصغر وحدة وظيفية للعضلة. يتكون كل قسيم عضلي بشكل أساسي من بروتينات الأكتين والميوسين والتيتين. أثناء الانكماش، يتم تقصير القسيم العضلي، وأثناء التوسع، يصبح أطول. تقع القسيمات العضلية بجانب بعضها البعض وتشكل بذلك اللييف العضلي. يتم تجميع العديد من اللييفات العضلية معًا وتشكل أليافًا عضلية
تقرير ميداني
لوكاس سي، 23 عامًا
نمط الحياة: اتباع نظام غذائي عادي، وممارسة الرياضة في الحياة اليومية
النتيجة: تبين في لجنة الوقاية أن لوكاس سي لديه استعداد للإصابة بارتفاع الحرارة الخبيث بسبب وجود متغير في جين RYR1.
النتيجة: يتلقى لوكاس سي الآن مخدرات بديلة أثناء الجراحة حتى لا يؤدي إلى رد الفعل الذي يهدد حياته.
"أردت إجراء اختبار الحمض النووي الخاص بي للحصول على نظرة عامة على صحتي وجسدي. لقد فوجئت عندما اكتشفت أن لدي استعداد للإصابة بمضاعفات التخدير هذه، ولكن بالطبع يسعدني أن أعرف الآن. إنه لأمر رائع ما يمكنك اكتشافه باستخدام أحدث التقنيات

كيف يعمل تقييم المخاطر الجينية؟

من خلال لوحة الوقاية في وحدة ارتفاع الحرارة الخبيث، يتم تحليل اثنين من الجينات المسؤولة عن أكثر من 70% من جميع الحالات. إن تحديد الاستعداد لذلك قبل التخدير يمكّن الطبيب المعالج من استخدام مخدر لا يثير هذا التفاعل.
مجموعة الجينات
يتم اختبار هذين الجينين في وحدة ارتفاع الحرارة الخبيث (PRV07):
CACNA1S، RYR1

الوقاية الجينية علم الوراثة الدوائي للتمثيل الغذائي
الوحدة PRV08
يمكن أن يؤثر التركيب الجيني للشخص على تأثير الأدوية ومدى تحملها. يعالج علم الوراثة الدوائي هذا الارتباط.
وبمساعدة لجنة الوقاية، يمكننا تحديد ما ينبغي مراعاته في سياق العلاج الدوائي للأشخاص الذين يطلبون المشورة. وهذا يمكن أن يدعم الأطباء المعالجين في العثور على الجرعة المناسبة بشكل فردي
ما هو علم الوراثة الدوائي؟
يتعامل علم الوراثة الدوائي مع التغيرات الجينية التي تؤثر على تأثير الأدوية (الشكل 1). وبعبارة أخرى، فهو يدرس مقدار العنصر النشط الذي يحتاجه الفرد لتحقيق تأثير معين.
يمكن للتغيرات الوراثية في البروتينات المسؤولة عن امتصاص المواد وتوزيعها واستقلابها وإفرازها أن يكون لها تأثير هائل على فعالية العديد من الأدوية وتحملها.
تشمل الأدوية التي تثير ردود فعل فردية لدى المرضى مضادات الاكتئاب، ومسكنات الألم، ومضادات الذهان، والعلاج الكيميائي، وأدوية الإيدز، وأدوية تجلط الدم، وأدوية التخدير، وحاصرات بيتا، والستاتينات، وغيرها.
تتحلل الأدوية في الكبد بواسطة بروتينات معينة تسمى الإنزيمات. الإنزيمات عبارة عن محفزات كيميائية حيوية يمكنها تسهيل استقلاب الأدوية.
الشكل 1: يمكن للتحليل الجيني اكتشاف العوامل التي تؤثر على استقلاب الدواء والمساعدة في تحديد الجرعة الفردية.
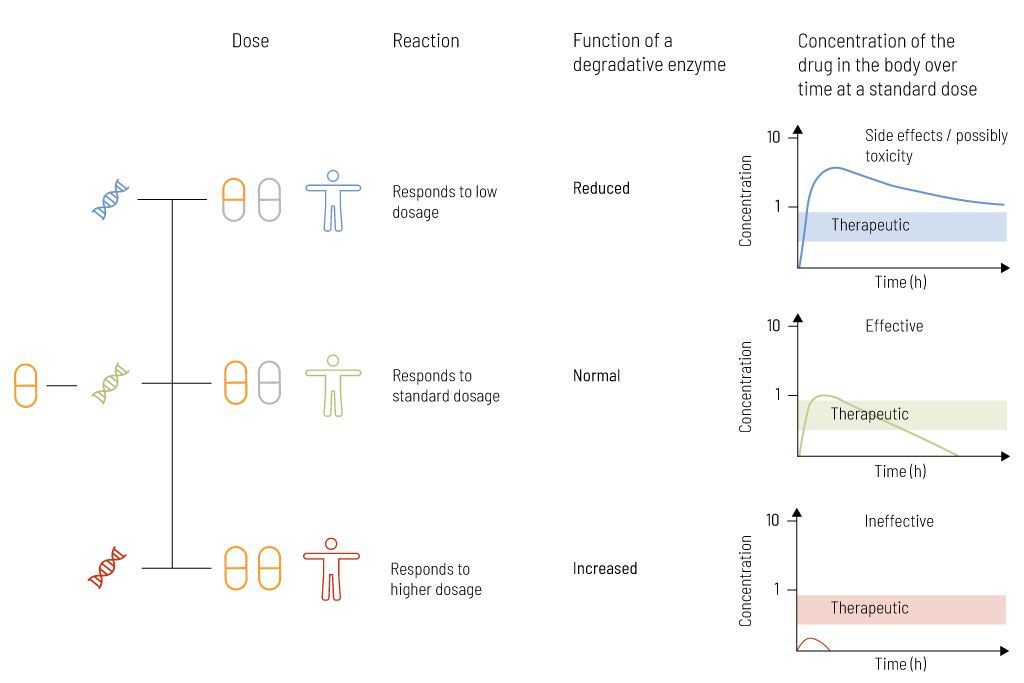
الشكل 2: بعض الأدوية ليس لها نفس التأثير على جميع الأشخاص. اعتمادًا على الاختلاف الجيني، تعمل الإنزيمات الموجودة في استقلاب الدواء بشكل مختلف. يمكن أن تؤدي هذه الظاهرة إلى تحطيم الجسم للدواء بسرعة أكبر أو ببطء أكبر. يمكن أن يؤدي هذا إلى زيادة أو نقص الجرعة، مما قد يؤدي إلى انخفاض التأثير أو آثار جانبية غير مرغوب فيها
إذا انخفض نشاط إنزيم معين أو غاب، فقد يتباطأ تحلل المادة الفعالة وقد تؤدي الجرعة القياسية إلى زيادة مستوى الدواء (الشكل 2). وهذا يمكن أن يؤدي إلى آثار جانبية غير مرغوب فيها، بما في ذلك السمية. في هذه الحالة، ينبغي النظر في جرعة أقل من الدواء. من ناحية أخرى، فإن نقص النشاط الأنزيمي المرتبط بالأدوية التي يتم تنشيطها فقط عن طريق التمثيل الغذائي في الجسم يمكن أن يؤدي إلى نقص التأثير العلاجي. يمكن أن تؤدي زيادة نشاط الإنزيم أيضًا إلى استجابة غير كافية للعلاج، على سبيل المثال بسبب التحلل السريع للمادة الفعالة. في هذه الحالات، ينبغي النظر في جرعة أعلى من الدواء.
وبالتالي فإن أفضل تأثير ممكن للدواء يكمن في المستوى الأمثل في النطاق المتوسط، والذي يشار إليه أيضًا باسم النطاق العلاجي. ولذلك ينبغي تكييف الجرعة الفردية المقابلة مع معدل التمثيل الغذائي للمريض لتلبية هذا النطاق العلاجي.
تقرير ميداني
إيزابيل ت.، 42 عامًا
نمط الحياة: الوعي الصحي
النتيجة: تم إنشاء ملف تعريفي دوائي لإيزابيل تي، والذي يوفر معلومات حول كيفية استقلابها للأدوية المختلفة. ومن بين أمور أخرى، تم تحليل النمط الجيني SLC01B1*1/*5. وهذا يزيد من احتمال حدوث بعض الآثار الجانبية، على سبيل المثال. أثناء العلاج بالستاتينات (دواء لخفض مستوى الكوليسترول).
النتيجة: تم توعية إيزابيل ت. من خلال الاختبار التنبؤي الجيني للعلاجات المستقبلية ويمكن للطبيب المعالج إجراء تعديلات على الدواء الحالي إذا لزم الأمر.
"بفضل تحليل علم الوراثة الدوائي، أعرف الآن خطر الإصابة بآثار جانبية من الستاتينات. إذا كنت بحاجة إلى خفض مستويات الكوليسترول في الدم باستخدام الدواء في وقت لاحق، فإن طبيبي يعرف بالفعل ما الذي يجب أن أبحث عنه بالضبط عند اختيار الدواء والجرعة.

كيف يعمل تقييم المخاطر الجينية؟

من خلال لوحة الوقاية الوراثية في وحدة علم الوراثة الدوائية، نقوم بتحليل اثنين وعشرين جينًا تشارك في استقلاب الأدوية. يمكن للطبيب المعالج تعديل جرعة الدواء بشكل فردي بناءً على الملف الوراثي الدوائي. وبهذا يمكن تقليل خطر حدوث آثار جانبية خطيرة أو فشل العلاج.
مجموعة الجينات
يتم اختبار هذه الجينات الاثنين والعشرون في وحدة علم الوراثة الدوائي (PRV08):
ABCG2، CACNA1S، CYP2B6، CYP2C19، CYP2C9، CYP2D6، CYP3A4، CYP3A5، CYP4F2، DPYD، G6PD، HLA-A، HLA-B، IFNL3، MT-RNR1، NUDT15، POR، RYR1، SLCO1B1، TPMT، UGT1A1، VKORC1

الوقاية الوراثية من مرض السكري العائلي
الوحدة PRV09
من خلال وحدتنا الخاصة بمرض السكري العائلي، نقوم بفحص الجينات المرتبطة بزيادة خطر الإصابة بداء السكري العائلي. إذا تم الكشف عن المتغيرات الجينية في وقت مبكر، فمن الممكن تنفيذ تدابير وقائية.
ما هو مرض السكري؟
يصف داء السكري مجموعة من الأمراض المرتبطة بارتفاع مستويات السكر في الدم. هناك أنواع مختلفة من مرض السكري، مثل مرض السكري من النوع 1، أو مرض السكري من النوع 2، أو MODY (مرض السكري عند النضج عند الشباب).
كل هذه الأنواع تشترك في ارتفاع السكر في الدم (ارتفاع مستويات السكر في الدم في الدم). يمكن أن يحدث هذا بسبب نقص أو عدم إطلاق هرمون الأنسولين الأيضي من خلايا بيتا في البنكرياس. يُطلق على الأنسولين اسم "المفتاح"، الذي يمكّن من امتصاص الجلوكوز في الخلايا (الشكل 1).
في البشر الأصحاء، يكون الأنسولين موجودًا دائمًا بمستوى منخفض لضمان إمداد الخلايا بالطاقة. بعد الوجبات، يرتفع مستوى الأنسولين ليتمكن من امتصاص الجلوكوز من التغذية. إذا لم يكن هناك ما يكفي من الأنسولين أو لا يوجد على الإطلاق، فإن امتصاص الجلوكوز يكون محدودًا. وبدلا من ذلك، يرتفع مستوى الجلوكوز في الدم.
يمكن لعوامل أخرى غير انخفاض إنتاج الأنسولين أن تكون مسؤولة أيضًا عن عملية التمثيل الغذائي لمرض السكري، على سبيل المثال. ضعف امتصاص الجلوكوز في خلايا الجسم عند مستوى الأنسولين الطبيعي (مقاومة الأنسولين). هنا، تتفاعل الخلايا بشكل أقل حساسية للأنسولين، مما قد يحد بشكل كبير من تأثيره.

الشكل 1: عندما يرتبط الأنسولين الرسول بالخلية، تنفتح قنوات الجلوكوز، مما يسمح بامتصاص السكر في الخلايا
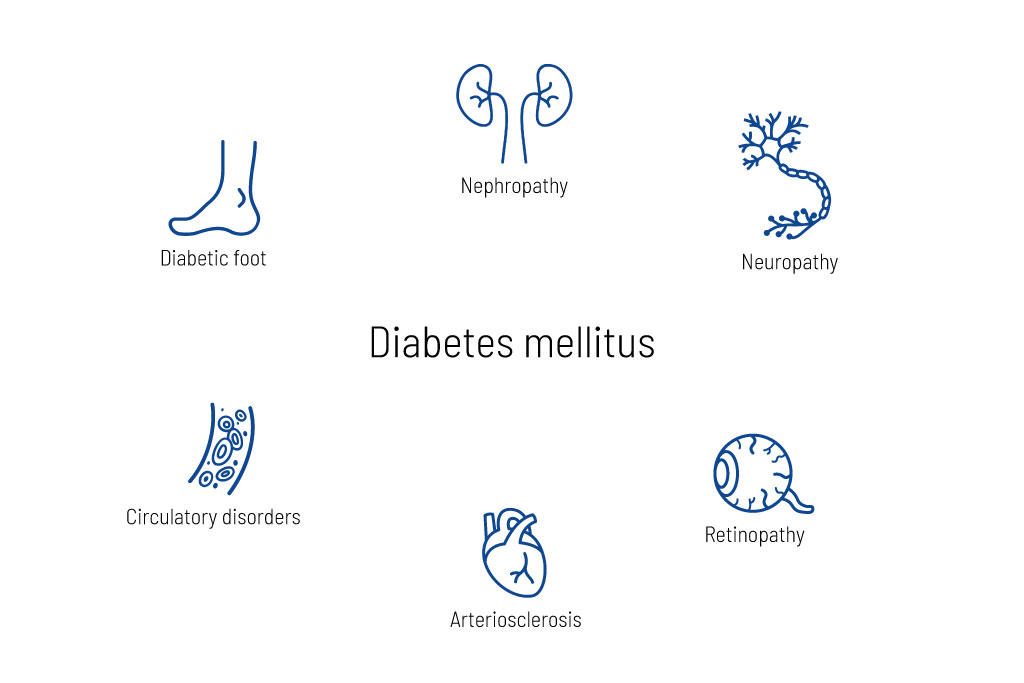
الشكل 2: الأمراض الثانوية لمرض السكري.
تلعب الوراثة دورًا رئيسيًا في تطور مرض السكري العائلي. في وحدتنا مرض السكري العائلي، يتم التركيز على نوع MODY (مرض السكري عند النضج عند الشباب). وهو مرض وراثي يمكن تشخيصه في مرحلة الشباب أو في مرحلة البلوغ وغالباً لا يصاحبه السمنة.
يمكن أن يمر المرض دون أن يلاحظه أحد في البداية، حيث أن ارتفاع مستوى السكر في كثير من الأحيان لا يسبب أي أعراض ملحوظة في البداية. خلال فترة المرض، اعتمادًا على مستويات الجلوكوز في الدم، يمكن أن تحدث مضاعفات الأوعية الدموية الدقيقة مثل تلف الكلى والعينين والأعصاب (الشكل 2). أيضًا، في حالة الإصابة بسكري الحمل، ينبغي للمرء أن يأخذ في الاعتبار وجود مرض السكري العائلي المسبب وراثيًا.
تقرير ميداني
ماركوس جي، 35 عامًا
نمط الحياة: اتباع نظام غذائي صحي، وممارسة القليل من التمارين الرياضية بسبب العمل المكتبي
النتيجة: اكتشف الاختبار الجيني الوقائي وجود خطر أعلى للإصابة بمرض السكري (نوع MODY) بالنسبة لماركوس جي بسبب وجود متغير في الجين PDX1.
النتيجة: قام ماركوس جي بتعديل أسلوب حياته. يهتم بنظامه الغذائي ويمارس التمارين الرياضية مرتين إلى ثلاث مرات في الأسبوع. إذا لزم الأمر، يمكن دعمه بالأدوية.
"لقد كنت بالفعل حساسًا لموضوع مرض السكري من خلال بيئتي. لذلك كنت مهتمًا بمعرفة ما إذا كنت معرضًا لخطر متزايد لتطويره بنفسي. بفضل لوحة الوقاية، تمكنت من تحديد أن لدي استعداد للإصابة بمرض السكري MODY حتى بدون ظهور أعراض. أنا الآن أهتم أكثر بنظامي الغذائي وأمارس الرياضة كثيرًا. أقوم أيضًا بقياس مستوى الجلوكوز في الدم بانتظام كإجراء وقائي حتى أتمكن من اتخاذ إجراءات مضادة مبكرة مع طبيبي إذا كانت لدي مستويات مرتفعة.

كيف يعمل تقييم المخاطر الجينية؟

في وحدة مرض السكري العائلي، يتم اختبار خمسة جينات مرتبطة بارتفاع خطر الإصابة بداء السكري العائلي. إذا تم الكشف عن هذه في وقت مبكر، يمكن اتخاذ التدابير الوقائية المناسبة.
اعتمادًا على شكل المرض، قد يتكون أي علاج ضروري من تعديلات نمط الحياة مثل تغيير النظام الغذائي و/أو العلاج الدوائي إذا لزم الأمر.
مجموعة الجينات
يتم اختبار هذه الجينات الخمسة في الوقاية من مرض السكري (PRV09):
GCK, HNF1A, HNF1B, HNF4A, PDX1

