الوقاية الوراثية من اضطرابات تخزين الحديد والنحاس
الوحدة PRV04
في حالة اضطراب تخزين الحديد أو النحاس، تتراكم المغذيات الدقيقة مثل الحديد أو النحاس بشكل مفرط في الجسم ويمكن أن تلحق الضرر بالأعضاء. يهدف التشخيص المبكر لهذا المرض الاستقلابي إلى تقليل المضاعفات المرتبطة به وتحسين نوعية حياة الأشخاص المصابين.
ما هي اضطرابات تخزين الحديد والنحاس؟
تعتبر العناصر النزرة مثل الحديد والنحاس ضرورية لجسمنا، لأنها تشارك في عمليات مهمة مثل نقل الأكسجين ونقل المحفزات في الخلايا العصبية. عند الأشخاص الذين يعانون من اضطرابات تخزين الحديد أو النحاس، يضطرب التوازن بين امتصاص وإفراز تلك العناصر. ونتيجة لذلك، يمكن أن تتراكم كميات زائدة من هذه المواد في العديد من الأعضاء والأنسجة، مما قد يسبب أضرارًا مختلفة وأعراضًا مرتبطة بها.
عادة ما تكون الأعراض غير محددة في البداية. على سبيل المثال، قد يحدث ضعف أو تعب أو ألم في البطن أو فقدان الوزن. وهذا يجعل تشخيص مثل هذا المرض صعبا في البداية بدون التحليل الجيني.
اضطراب تخزين النحاس يمكن أن يؤدي مرض ويلسون إلى زيادة تراكم النحاس في الكبد والعين والجهاز العصبي المركزي والأعضاء الأخرى (الشكل 1). وهذا يؤدي إلى نمط متنوع من الأعراض
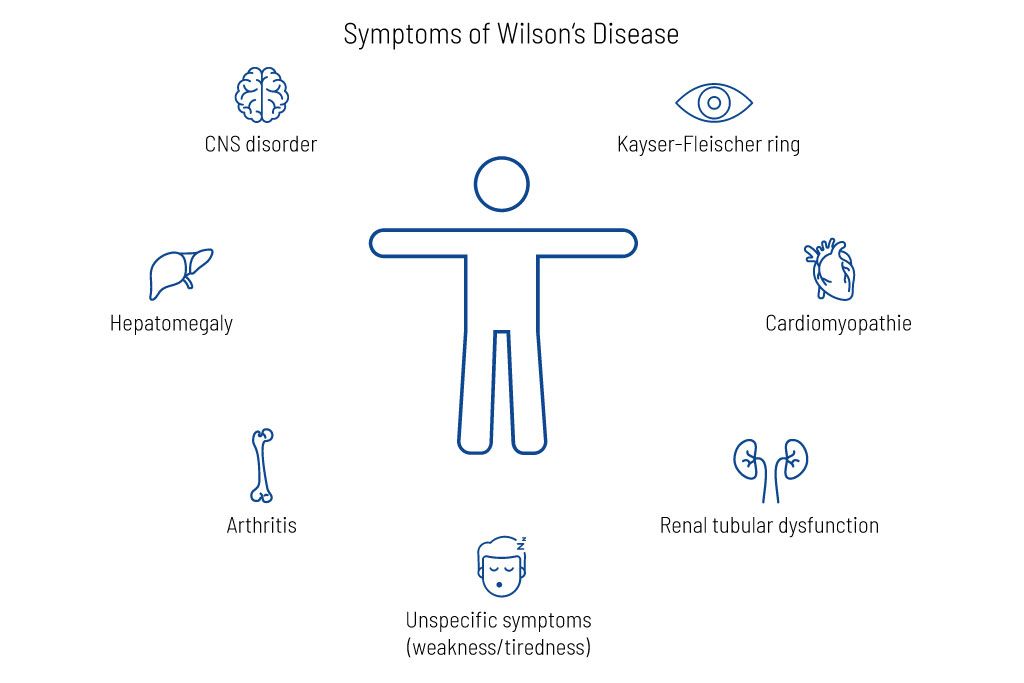
الشكل 1: أعراض مرض ويلسون
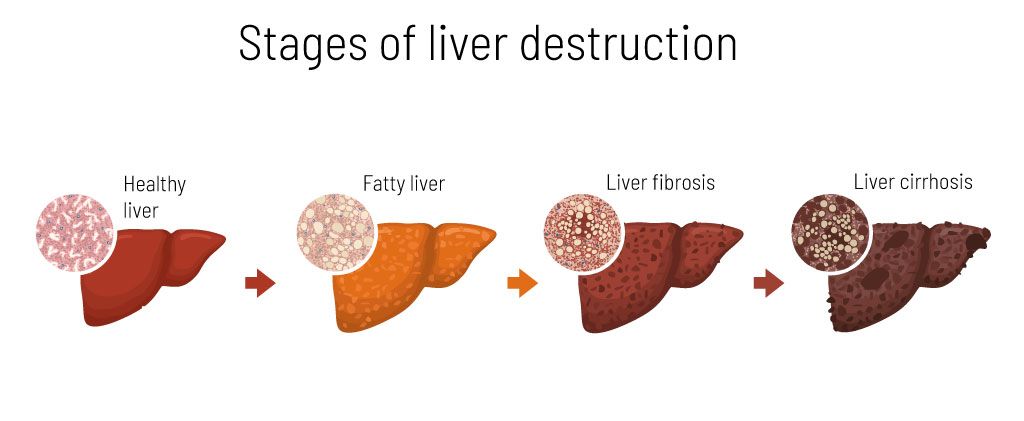
الشكل 2: مراحل تدمير الكبد.
على المدى الطويل، يمكن أن يؤدي تراكم الكثير من الحديد أو النحاس أيضًا إلى ظهور أعراض خاصة بالأعضاء، مثل تلف الكبد (مثل تليف الكبد وسرطان الكبد) (الشكل 2).
تقرير ميداني
تاميكا ك.، 24 عامًا
نمط الحياة: نظام غذائي صحي، نشط للغاية في الرياضة
النتيجة: حددت تشخيصاتنا الوقائية لـ Tamika K. متغيرًا في الجين HFE الذي يزيد من خطر الإصابة بداء ترسب الأصبغة الدموية الناتج عن اضطراب تخزين الحديد.
النتيجة: تشارك تاميكا ك. في فحوصات وقائية منتظمة وستتلقى، إذا لزم الأمر، علاجًا لعلاج داء ترسب الأصبغة الدموية لتجنب الأعراض وأحيانًا تلف الأعضاء الذي لا يمكن علاجه.
"لقد فوجئت عندما اكتشفت أن لدي متغيرًا يمكن أن يسبب حالة تسمى داء ترسب الأصبغة الدموية. تسبب هذه الحالة تراكم الحديد في الكبد. ولحسن الحظ، من الممكن علاج المرض وبالتالي تجنب المضاعفات قدر الإمكان.

كيف يعمل تقييم المخاطر الجينية؟

يمكن للتحليل الجيني الوقائي بمساعدة تقنية تسلسل الجيل التالي (NGS) التنبؤ بخطر الإصابة بمرض معين قبل تفشيه.
في وحدة اضطرابات تخزين الحديد والنحاس، يتم فحص ثمانية جينات تلعب دورًا في عملية استقلاب الحديد أو النحاس. إذا تم الكشف عن التغيرات المسببة للمرض، يمكن لهؤلاء الأشخاص بدء العلاج المناسب عند الضرورة ومنع الأضرار المحتملة.
مجموعة الجينات
يتم اختبار هذه الجينات الثمانية في وحدة أمراض تخزين الحديد والنحاس (PRV04):
ATP7B، CP، GLRX5، HAMP، HFE، HJV، SLC40A1، TFR2

الوقاية الوراثية من ارتفاع الكولسترول في الدم
الوحدة PRV05
في حالة فرط كوليسترول الدم، يضطرب استقلاب الدهون، مما يؤدي إلى ارتفاع مستويات الدهون في الدم (مثل البروتين الدهني منخفض الكثافة، والكوليسترول المنخفض الكثافة LDL)، مما قد يؤدي، على سبيل المثال، إلى زيادة خطر الإصابة بالنوبات القلبية. إذا كان الاستعداد لفرط كوليسترول الدم معروفًا وكانت مستويات كوليسترول البروتين الدهني منخفض الكثافة (LDL) مرتفعة، فيمكن اتخاذ تدابير وقائية لخفض مستوى كوليسترول الدم وبالتالي تقليل خطر الإصابة بنوبة قلبية.
ما هو فرط كوليسترول الدم؟
يعد الكوليسترول جزءًا أساسيًا من جسمنا وهو ضروري على سبيل المثال لبناء الهرمونات أو لبناء غشاء الخلية. والكوليسترول، مثل الدهون، لا يذوب في الدم. ولذلك، هناك حاجة إلى نظام نقل لنشر الكولسترول في الجسم. لهذا، يتم استخدام مجمعات HDL (البروتين الدهني عالي الكثافة) وLDL (البروتين الدهني منخفض الكثافة).
يقوم HDL بنقل الكولسترول الزائد في الجسم إلى الكبد، حيث يمكن أن يتحلل. بشكل عام، يطلق عليه الكولسترول "الجيد". ينقل LDL الكولسترول من الكبد إلى خلايا الجسم الأخرى. يمكن لهذه الخلايا تناول LDL مع الكولسترول المرتبط عبر مستقبل محدد، مستقبل LDL. يرتبط ارتفاع مستوى LDL بزيادة خطر الإصابة بأمراض القلب والأوعية الدموية. ولذلك، يُعرف LDL عمومًا باسم الكوليسترول "الضار".
مع فرط كوليسترول الدم العائلي (FH)، في 85٪ إلى 90٪ من الحالات، هناك متغير (تغيير) في الجين لمستقبل LDL هذا. وهذا يمكن أن يؤدي إلى ضعف امتصاص الكولسترول LDL في الخلية. لذلك، يتعلق الأمر باضطراب وراثي في استقلاب الدهون. في حالة فرط كوليسترول الدم العائلي، يمكن أن يرتفع مستوى الكولسترول LDL إلى ما بين ضعفين إلى عشرة أضعاف القيمة الطبيعية. يزيد ارتفاع مستوى الكولسترول LDL في الدم من خطر ترسبات في الأوعية الدموية على شكل لويحات دهنية وبالتالي أيضًا من خطر الإصابة بالنوبات القلبية على سبيل المثال.
(شكل 1).
من المفترض أن يحدث هذا الاضطراب بمعدل تكرار 1:500 ولكن يتم تشخيصه في 15% فقط من الحالات. عند الشباب، عادة ما يتم تشخيص اضطراب استقلاب الدهون فقط بعد الإصابة بنوبة قلبية. العوامل التشخيصية الأخرى هي:
- تراكم النوبات القلبية في الأسرة،
- الورم الأصفر (رواسب الدهون العقدية في الجلد)، أو
- زيادة كبيرة في مستوى الكولسترول LDL في الدم.
ومن خلال التشخيص المبكر، ينخفض بشكل واضح خطر الإصابة بالترسبات الوعائية والنوبات القلبية.
أحد أشكال العلاج لخفض مستويات الجلوكوز في الدم هو إعطاء الأدوية الخافضة للدهون (مثل الستاتينات). في سياق وحدة استقلاب الأدوية (علم الوراثة الدوائي)، يبحث CeGaT في الملف الجيني الذي يؤثر على استقلاب أدوية خفض الدهون (الستاتينات) في الجسم. ومن خلال هذه المعرفة، يستطيع الطبيب المعالج تعديل الجرعة بشكل فردي، وفقًا للملف الجيني. كما يتم تضمين أدوية أخرى في هذا التحليل.
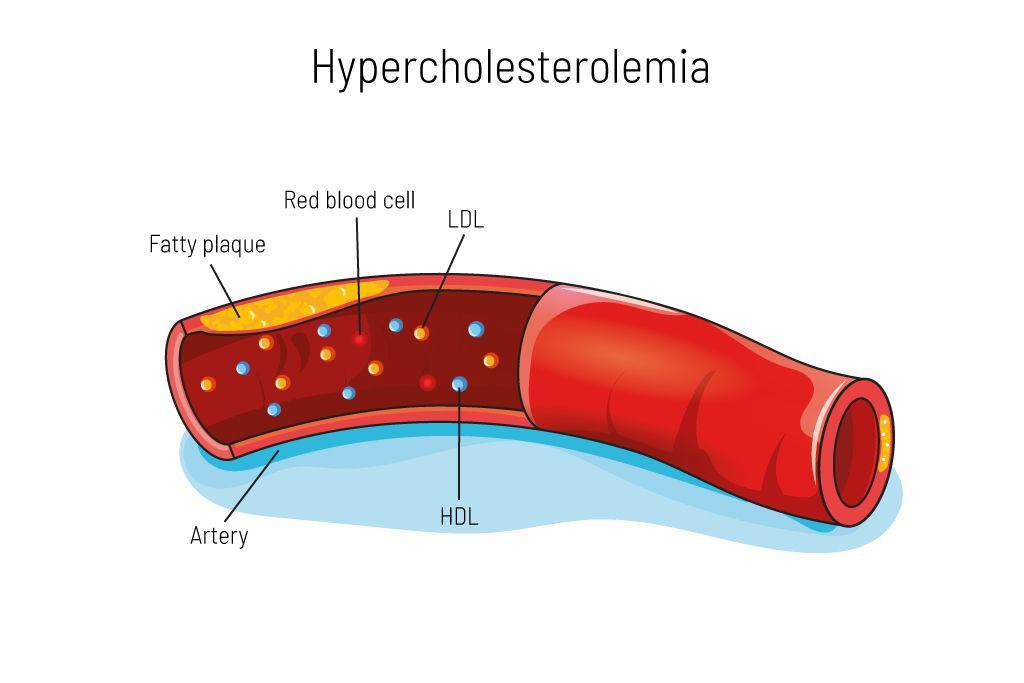
الشكل 1: فرط كوليسترول الدم هو اضطراب استقلابي للدهون، حيث يوجد على سبيل المثال كوليسترول LDL، المعروف أيضًا باسم الكوليسترول "الضار"، في الدم بمستويات مرتفعة. إذا كان هناك الكثير منه في الدم، فإنه يتراكم في الشرايين ويمكن أن يؤدي إلى تكوين لويحات دهنية. وهذا يزيد من خطر الإصابة بالنوبات القلبية والسكتات الدماغية.
تقرير ميداني
باتريك ر.، 30 عامًا
نمط الحياة: اتباع نظام غذائي عادي، وعدم ممارسة الكثير من التمارين الرياضية
النتيجة: من خلال تسلسل المعلومات الجينية لباتريك ر.، تم العثور على خطر متزايد لارتفاع مستويات الكوليسترول في الدم من خلال متغير في الجين LDLR.
النتيجة: يتم الآن فحص قيم الدهون في الدم لدى باتريك ر. بشكل منتظم. يهتم بنظامه الغذائي ويمارس الرياضة بانتظام.
"لقد تعرضت لعدة نوبات قلبية في بيئتي الاجتماعية، لذلك قمت باختبار جيناتي. أظهر التحليل أن لدي تغيير في جين LDLR. الآن أعرف ما يجب أن أفعله للوقاية من الأمراض الثانوية.

كيف يعمل تقييم المخاطر الجينية؟

من خلال لوحة الوقاية في وحدة فرط كوليسترول الدم، يتم اختبار أربعة جينات ذات صلة، بما في ذلك الجين الخاص بمستقبل LDL والبروتينات التي تؤثر على وظيفة المستقبل. يساعد التشخيص المبكر للمرض على علاجه في الوقت المناسب عن طريق خفض مستويات الكوليسترول الضار وتكييف نمط الحياة للوقاية من الأمراض الثانوية.
مجموعة الجينات
يتم اختبار هذه الجينات الأربعة في وحدة فرط كوليسترول الدم (PRV05):
APOB, LDLR, LDLRAP1, PCSK9

الوقاية الوراثية من الجلوكوما
الوحدة PRV06
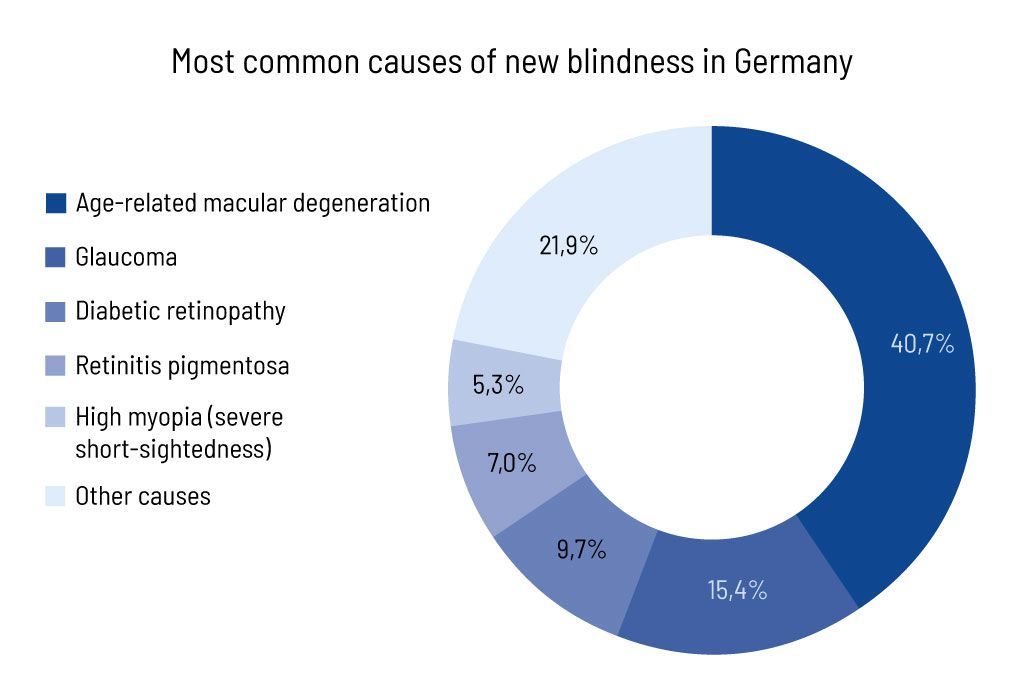
يعد الجلوكوما أحد أكثر أمراض العصب البصري انتشارًا ويمكن أن يسبب العمى (الشكل 1). يمكن أن يحدث ذلك مرتبطًا بالعمر، ولكن في حالة الجلوكوما الناتجة عن الجينات، يمكن أن يحدث أيضًا في مراحل مبكرة من الحياة. يعد الكشف المبكر عن الجلوكوما أمرًا مهمًا لمنع فقدان ألياف العصب البصري، وأخيرًا العمى.
الشكل 1: نسبة أسباب العمى الأكثر شيوعاً بين حالات العمى الجديدة (معدلة).
ما هو الجلوكوما؟
تقوم أعيننا بمعالجة الصور من البيئة المحيطة عن طريق تجميع الضوء الساقط في شبكية العين ونقل المعلومات عبر العصب البصري إلى الدماغ. وللقيام بذلك، يجب أن يمر الضوء عبر القرنية والغرفة الأمامية للعين والبؤبؤ والعدسة والجسم الزجاجي إلى شبكية العين.
يتكون الجسم الزجاجي من مادة هلامية شفافة تعطي العين شكلها. يزودها ما يسمى بالسائل المائي الموجود داخل العين بالمواد المغذية ويؤثر على ضغط العين. يتم إعادة بناء السائل المائي باستمرار. إذا لم يتمكن من التصريف بشكل صحيح، يزداد ضغط العين ويمكن أن يتلف العصب البصري (الشكل 2). وهذا أحد أسباب الجلوكوما.
يعد الجلوكوما أحد الأسباب الأكثر شيوعًا للعمى في جميع أنحاء العالم. يؤدي انحطاط الخلايا العصبية في العصب البصري إلى فقدان المجال البصري بشكل لا رجعة فيه وفي النهاية إلى العمى. تشمل عوامل الخطر على سبيل المثال ارتفاع ضغط العين والسكري والتهاب العين المزمن وأمراض القلب والأوعية الدموية. يعتمد حوالي 5% من حالات الجلوكوما على التغيرات الجينية الموروثة، والتي يمكن أن تؤدي إلى ظهور المرض في مرحلة مبكرة من الحياة.

الشكل 2: هيكل العين البشرية. اليسار: عين سليمة، اليمين: زيادة ضغط العين في الجلوكوما.
تقرير ميداني
نينا ب.، 37 عامًا
نمط الحياة: رياضي، مغامر
النتيجة: من خلال تشخيصنا الوقائي لـ Nina B.، حددنا زيادة خطر الإصابة بالجلوكوما من خلال متغير في الجين MYOC.
النتيجة: نينا ب. تجري الآن فحوصات منتظمة للعين. على سبيل المثال، يتم فحص ضغط العين والجزء الخلفي من العين من أجل منع عيوب المجال البصري والحفاظ على رؤيتها.
"لدي استعداد وراثي للإصابة بالجلوكوما. ولهذا السبب أقوم الآن بزيارة طبيب العيون على فترات منتظمة لفحص حالة عيني، وإذا لزم الأمر، لأتمكن من التدخل في مرحلة مبكرة.

كيف يعمل تقييم المخاطر الجينية؟

في وحدة الجلوكوما، يتم استخدام NGS لفحص اثنين من الجينات المسؤولة عن حدوث الجلوكوما.
إذا تم الكشف عن زيادة خطر الإصابة بالجلوكوما من خلال لوحة الوقاية من الأمراض، فإن برامج الكشف المبكر المناسبة يمكن أن توفر الفرصة للعلاج في الوقت المناسب في حالة المرض. يؤدي الكشف المبكر عن الجلوكوما إلى تشخيص أكثر إيجابية، حيث يمكن إبطاء تطور المرض أو حتى إيقافه باستخدام العلاج المناسب.
مجموعة الجينات
يتم اختبار هذين الجينين للوقاية من الجلوكوما (PRV06):
CYP1B1, MYOC

