CANCERPRECISION®
يمكن التعامل المستهدف لمرضاك

لا يوجد شيء مثل "حجم واحد يناسب الجميع" في علم السرطان، حيث أن ورم كل مريض فريد. لذا، من الأساسي فهم تاريخ المرض وكل ورم بأكمله بقدر الإمكان. يساعد تحليل الجينوم الشامل للأورام في اكتشاف التغييرات الجينية ذات الصلة بالعلاج في جينات السرطان للأورام الصلبة ويوفر معلومات قيمة لاختيار العلاج الأكثر كفاءة لكل مريض.
يوفر ®CancerPrecision تحليلاً جينياً جزيئياً أمثل باستخدام تقنية NGS ويشكل الأساس لعلاج السرطان الشخصي المستند إلى علامات الأحياء.
لقد التزمنا بشكل كامل بهذا الهدف في CeGaT. بفضل خبرتنا الطويلة في التشخيص الجيني، قمنا بتحسين تشخيص الأورام الجسمية لتحديد التغيرات الجسمية التي تعزز نمو الورم، وتكون مسؤولة عن مقاومة العقاقير، وتمثل أهدافًا علاجية محتملة. من خلال استخدام تقنية NGS، نحلل لوحًا يضم أكثر من 700 جين مرتبط بالأورام والتحولات الجينية المختارة للعلاج في أكثر من ثلاثين جينًا. تسمح التحليلات الاختيارية المستندة إلى الرنا المستهدف بالكشف عن جينات التحول بشراكات جديدة ومعروفة في أكثر من 150 جين. من المعروف أن التغييرات في هذه الجينات تؤثر بشكل كبير على تكوين الورم، وتقدمه، وانتقاله.
فيما يتعلق بالعلاجات المناعية، نحدد حمولة التحول الورمي (TMB)، وعدم الاستقرار الجيني في الساتل المجهري (MSI)، والعدوى الفيروسية (HPV، EBV). بالإضافة إلى ذلك، نحدد حالة نقص التركيب المتجانس (HRD)، التي توفر معلومات رئيسية، مما يسمح بتوقع استجابة مثبطات PARP وعلاجات الكيمياء البلاتينية بناءً على القتل الاصطناعي. بعد مدة معالجة تتراوح بين 2-3 أسابيع، يتم تلخيص البيانات المولدة في تقرير شامل باستخدام المعرفة العلمية الحالية لدعم الطبيب المعالج في إيجاد علاج فعال لكل مريض.
®CANCERPRECISION هو الاختيار الأول لتوصيف الأورام
تغطية عالية
تغطية التسلسل لاكتشاف التباينات الفرعية: 500-1,000 مرة
أعلى جودة
تسلسل وتحليل أكثر من 700 جين وتحولات في أكثر من 30 جينًا
تحليل الشرائط المندمجة
التحليل المستهدف للشرائط المندمجة بناءً على RNAممكن.
حساسية
الحساسية*: أكثر من 96%
الخصوصية: أكثر من 99.9%
* بناءً على عينة عالية الجودة بنسبة 20٪ من محتوى الورم لاكتشاف تغير جسدي ثنائي الأنواع.
تفاصيل الخدمة
تسلسل وتحليل كامل لأكثر من 700 جين مرتبط بالأورام والتحولات في أكثر من 30 جين
تغطية متوسطة عالية للتسلسل تصل إلى 500-1,000 مرة تتيح اكتشاف التغييرات ذات الصلة بالعلاج في النواتج الفرعية
حساسية: أكثر من 96%*؛ خصوصية: أكثر من 99.9%
تحليل لحمولة التحول الورمي (TMB)، وعدم الاستقرار في الساتل المجهري (MSI)، والعدوى الفيروسية (HPV، EBV) — علامات حيوية أساسية للعلاجات المناعية.
تحليل لنقص إعادة التركيب المتجانس (HRD) — علامة حيوية أساسية لتثبيط PARP.
تحليل للتحوّرات النيكليوتيد الفردية (SNVs)، والإدخالات والحذف (indels)، والانتقالات، والتغييرات في عدد النسخ (CNVs).
بالإضافة إلى التحولات الجسمية (الخاصة بالأورام) التي تؤثر على العلاج، يتم أيضًا الإبلاغ عن التحولات الجرثومية السببية للمرض وذات الصلة بالعلاج
تحليل للتحولات الجرثومية ذات الصلة بالصيدلانيات والضرورية لتعديل جرعة الدواء لمرضاك
قائمة بجميع الأدوية المؤهلة، مع الموافقة من الوكالة الأوروبية للأدوية (EMA) و/أو إدارة الأغذية والعقاقير الأمريكية (FDA)، والتي يمكن اكتشاف علامات حيوية مقابلها في الورم.
كشف التباينات الفسيفسائي: CHIP (تكون الدم الخلوي الوظيفي غير المحدد)
خدمة اختيارية
تحليل للشرائط المندمجة بناءً على الرنا من رنا الورم يحلل أكثر من 150 جينًا (®CancerFusionRx).
* بناءً على عينة عالية الجودة بنسبة 20 % من محتوى الورم لاكتشاف تغير جسدي ثنائي الأنواع.

متطلبات العينة القياسية لدينا
مواد عينة إضافية
مصادر مواد العينات الأخرى ممكنة حسب الطلب. يرجى ملاحظة: في حالة جودة العينة غير الكافية أو محتوى الورم، قد تفشل النتائج في التحليل.
إذا كان لديك أكثر من خيار لعينات الأورام، يرجى الاتصال بنا على info@germangeneticsservices.com، وسنساعدك في اختيار العينة الأمثل لمريضك.
للحصول على أقصى دقة، نحن بحاجة إلى النسيج الورمي والطبيعي للوح الأورام الجسمية لدينا.
النسيج الورمي
محتوى الورم على الأقل 20٪
كتلة ورم FFPE:
الحد الأدنى لحجم النسيج: 5 × 5 × 5 ملم (نوع العينة الموصى به)
شرائح أنسجة ورم FFPE:
الحد الأدنى لعدد الشرائح: 10 شرائح بسمك 4-10 ميكرومتر، وحجم النسيج: 5 × 5 ملم
حمض الديوكسي ريبوز النووي الجيني:
أكثر من 200 نانوغرام
نسيج ورم طازج مجمد:
3 × 10 أنابيب cfDNA للتحليل السائل
النسيج الطبيعي
- 1–2 مل من الدم المضاف إليه EDTA (نوع العينة الموصى به)
- حمض الديوكسي ريبوز النووي الجيني (1–2 ميكروغرام)
العملية التشخيصية

هذا ما يجعل خدمة ®CancerPrecision الخاصة بنا مميزة.
فهم ملف الأورام الجيني الجزيئي أمر أساسي لتخصيص علاج المريض وتحديد خيارات العلاج الإضافية. عدد العلامات التي نعالجها في تقريرنا CancerPrecision® عالي جدًا. لذلك، يتم تقسيم النتائج إلى فئات رئيسية وتقديمها على شكل صناديق. يتم تسليط الضوء على الصناديق ذات النتائج ذات الصلة بالعلاج بألوان.
نقدم صناديق فردية لمحتوى الورم، وحمولة التحول الورمي (TMB)، وعدم استقرار الساتل المجهري (MSI)، وتسجيل HRD للعينة الورمية المحللة، والعثور على التغيرات الهيكلية، والتحولات الجينية الدافعة للورم، والأدلة على العدوى الفيروسية (HPV/EBV)، والتحولات الجرثومية (التي تفسر مرض المريض)، والتحولات الجينية الصيدلانية ذات الصلة بعلاجات السرطان، واحتمال وجود تكون الدم الخلوي الوظيفي غير المحدد (CHIP).
مقارنة الأنسجة الورمية بالأنسجة الطبيعية
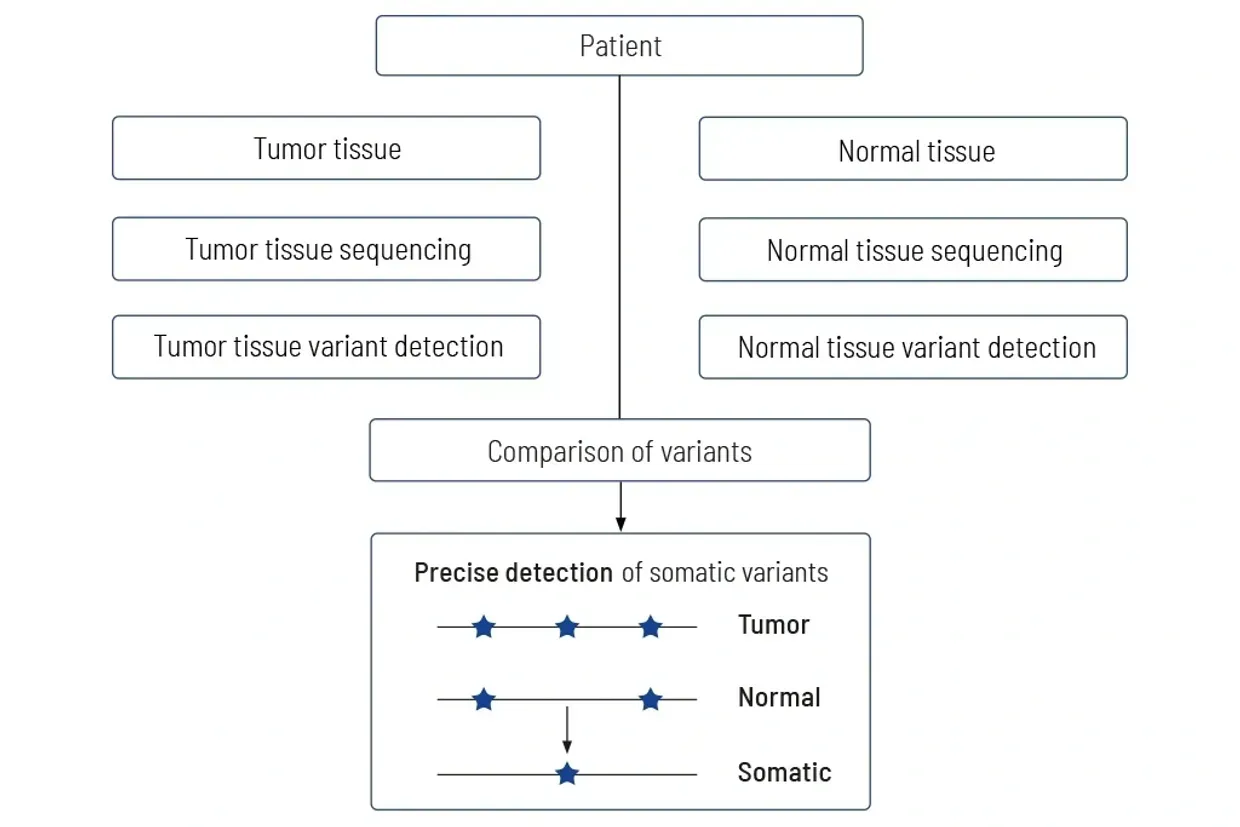
الطريقة الوحيدة الدقيقة لتحديد التباينات الجسمية
مقارنة الأورام مع الأنسجة الطبيعية المتطابقة ضرورية للحصول على نتائج معنوية. الاختبارات التشخيصية التي لا تحلل الأورام والأنسجة الطبيعية المتطابقة عادة ما تعطي نتائج غير دقيقة. في CeGaT، نقوم دائمًا بتسلسل أنسجة الورم وأنسجة الطبيعية المتطابقة لتشخيصنا CancerPrecision®.
المعلومات الدقيقة حول جينات الورم مطلوبة للتفسير الصحيح. في تشخيص الأورام، من المهم للغاية التمييز بين التباينات التي تقتصر على الورم (التباينات الجسمية) مقارنة بتلك الموجودة أيضًا في الأنسجة الصحية (التباينات الجرثومية).
الطريقة الوحيدة الدقيقة لتحديد التباينات في الأنسجة الصحية هي تسلسل الأنسجة الطبيعية المتطابقة مع الأنسجة الورمية. تفشل الطرق التي تحاول استبدال تسلسل الأنسجة الطبيعية بوسائل معلومات حيوية في تمييز واضح بين التباينات الجرثومية والجسمية، خاصة عندما يكون محتوى الورم في العينة مرتفعًا. يمكن أن يؤدي تسلسل الأنسجة الورمية فقط إلى حساب غير صحيح لحمولة التحول الورمي، والتي في أسوأ الحالات قد تؤدي إلى عدم حصول المرضى على علاج مثالي.
لذا، نقوم دائمًا بتسلسل الحمض النووي من الورم وكذلك من الأنسجة الطبيعية (غالبًا ما يكون الدم). يتم مقارنة بيانات التسلسل لكل من الأنسجة، وبالتالي يتم تحديد التباينات الجسمية بدقة.
التباينات ذات الأهمية العلاجية المحتملة
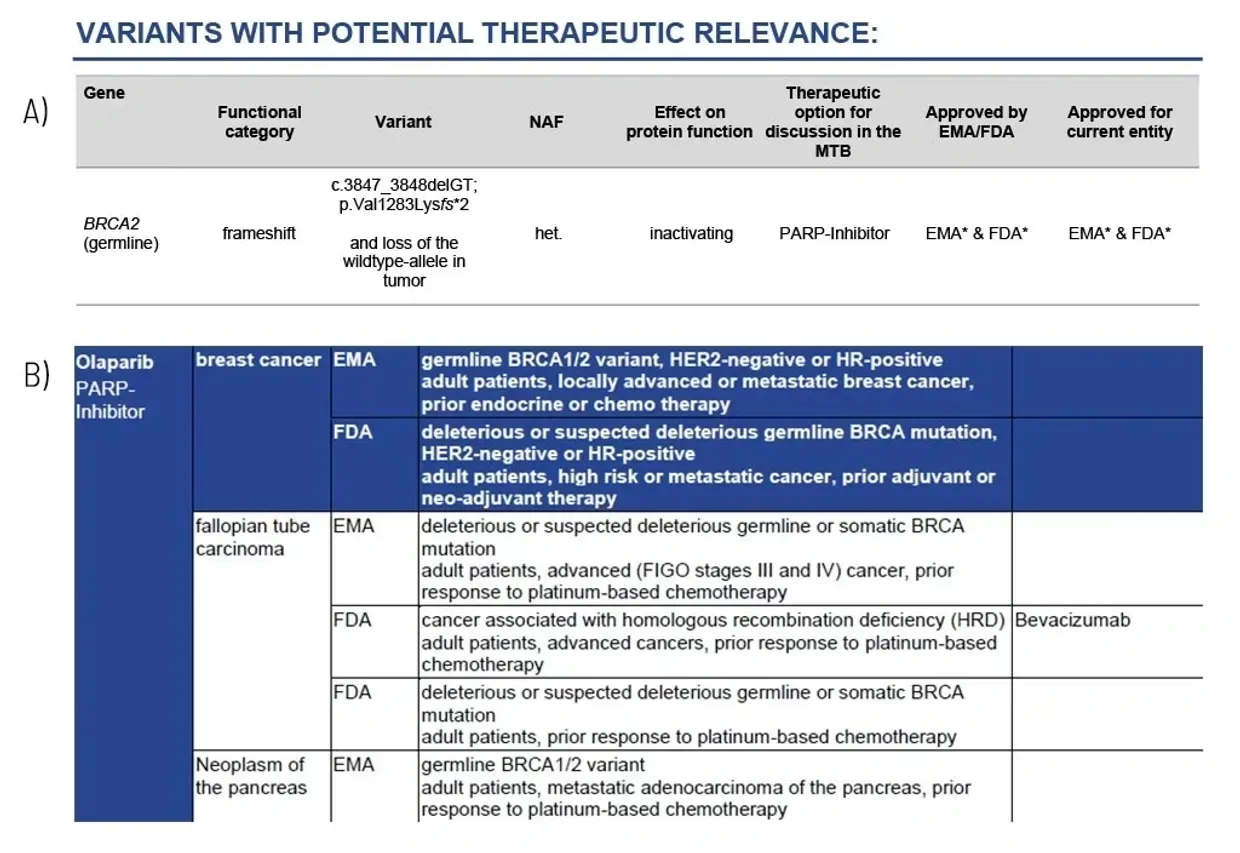
توجيهات حول الأدوية الفعالة بشكل محتمل
يُصوّر لكل جين التغيير الجسدي بالتفصيل، وتُذكر الخيارات العلاجية الناتجة، بما في ذلك الموافقة من هيئة الأدوية الأوروبية (EMA) / إدارة الغذاء والدواء الأمريكية (FDA) (A). تعتبر هذه الخيارات أساسًا للمناقشة في لجنة الورم الجزيئية (MTB).
في نهاية التقرير الطبي، في المرفقات/الإضافات، نقدم قائمة شاملة من استراتيجيات العلاج المحتملة لكل تغيير جسدي محدد (B). تتضمن هذه القائمة فئات الأدوية وأسماؤها بالإضافة إلى موافقتها (FDA/EMA) والشروط العقيدية.
توضيح المسار
لفهم مفصل للإشارات المُعدلة
ينشأ السرطان نتيجة سلوك الخلية غير الطبيعي المتعلق بنمو الخلية وبقائها على قيد الحياة. تصبح كلا العمليتين غير قابلتين للتحكم في سياق تطور الورم. عادةً ما تكون جميع العمليات الخلوية مُنظمة بشدة ومسيطرة بواسطة شبكة معقدة من المسارات الإشارية.
توفر تقريرنا الطبي رؤية شاملة لشبكة المسارات الإشارية المرتبطة بالسرطان و"اللاعبين الرئيسيين" الجزيئيين فيها وجميع التغييرات الجينية ذات الصلة وفئات الأدوية المتاحة ل:
فهم التفاعلات بين مختلف المسارات الإشارية، و
مواجهة استراتيجيات تجاوز الورم المحتملة.
تحتوي الأورام على تحورات في الجينات التي تلعب دورًا رئيسيًا في هذه المسارات الإشارية المعقدة. في هذا السياق، يمكن لتغير واحد جيني أن يؤثر على مسارات متعددة. لذلك، من الأساسي فهم تداخل المسارات الإشارية، التي تتأثر بها العديد من الطفرات الجينية، بجانب اكتشاف التحورات المرتبطة بالمرض. تساعد هذه النهج في تحديد استراتيجيات التجاوز المحتملة لورم معين للنظر في جميع الخيارات العلاجية الممكنة، بما في ذلك العلاجات المُجمّعة الفعّالة.
المسارات الإشارية المُعتبرة
- الإشارة عبر مستقبلات التيروزين كيناز
- دورة الخلية
- إصلاح الضرر في الحمض النووي
- المسارات الهرمونية
- مسار Wnt
- المسار القنفذي
- مسار قصور الغدة الدرقية
- مسار البرمجة للخلية الميتة (Apoptosis)
- مُنظمون علم التخلق
تحديد حمولة التحول الورمي وتوقع عدم استقرار الساتل المجهري (TMB و MSI)
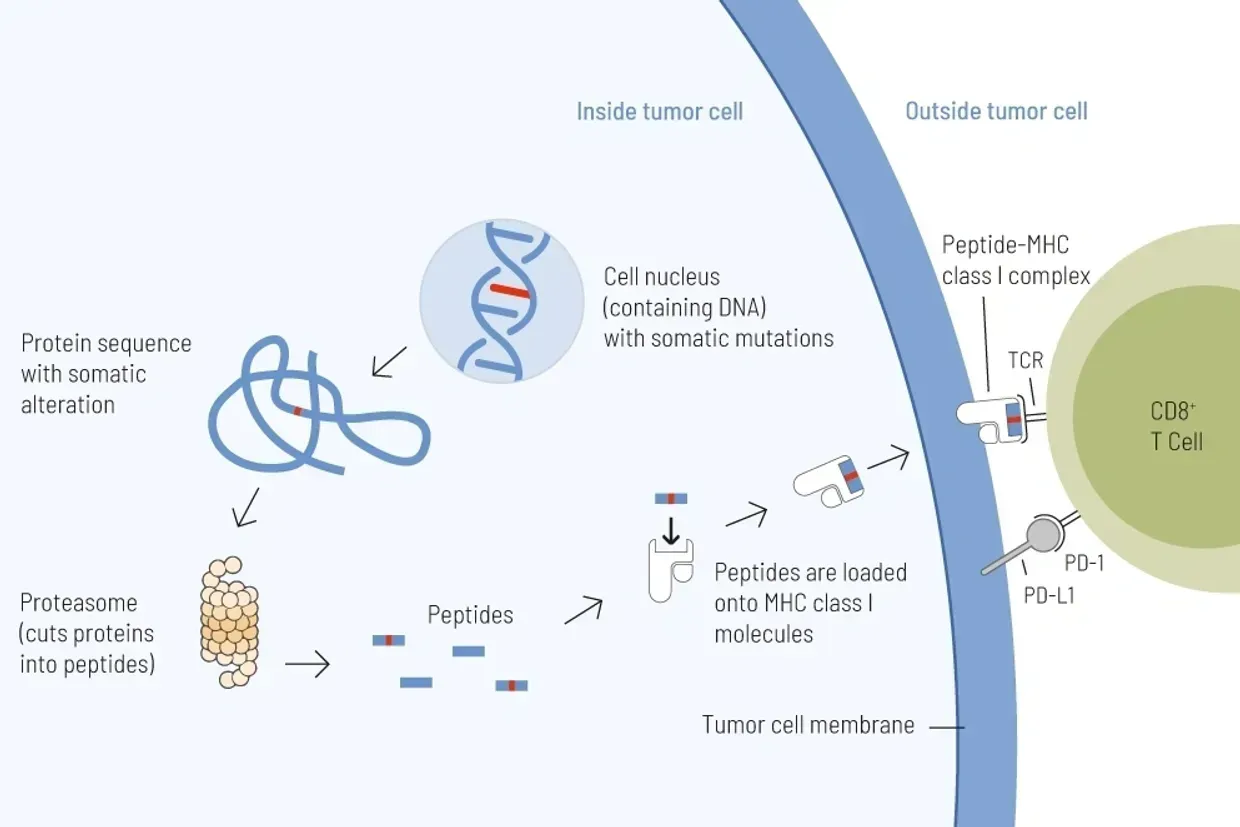
الأساس لاتخاذ القرارات العلاجية بشأن العلاجات المناعية باستخدام مثبطات نقاط التفتيش
تعد حمولة التحول الورمي (TMB) - عدد التحولات الجسمية لكل ميغابايت (MUT/MB) - علامة تنبؤية موثوقة للاستجابة للعلاج بمثبطات نقاط التفتيش المناعية.
كلما زاد عدد التباينات الجينية داخل خلية الورم، زادت البروتينات المتحورة التي يتم التعبير عنها. تُعالج هذه البروتينات المتحورة إلى شظايا قصيرة (ببتيدات) تُعرض على سطح خلايا الورم. تُسمى هذه الببتيدات المتحورة المستضدات الجديدة. تُعد المستضدات الجديدة شديدة المناعية، مما يعني أنها تُعرف بفعالية كبيرة بواسطة خلايا المناعة، وخاصة خلايا T. خلايا T قادرة على القضاء على خلايا الورم عند التعرف على مستضد مباشرة. لذلك، كلما زاد عدد التحورات، زادت فرصة عرض المستضدات الجديدة على خلايا الورم، وبالتالي يكون القضاء على الورم بواسطة خلايا T أكثر فعالية.
من خلال تسلسل مجموعة كبيرة من الجينات لكل من الأنسجة الطبيعية والورمية بحساسية عالية، يمكننا حساب TMB بدقة. يُستخدم هذا المقياس لتصنيف الأورام إلى منخفضة وعالية الحمل الطفريه. نقوم بتحديد تصنيف TMB بالإضافة إلى معدل التحور الدقيق لعينة الورم. عند حساب TMB، تكون حجم اللوحة حاسمة لدقة النتائج. مع حجم 2.2 ميغابايت، تتفوق CANCERPRECISION® على الحد الأدنى المطلوب البالغ 1.5 ميغابايت وتضمن تقديرًا قويًا لـ TMB.
يُعد عدم استقرارا ساتل المجهري (MSI) أيضًا معيارًا حاسمًا للاستجابة لحظر نقاط التفتيش المناعية. ساتل المجهري هي تسلسلات صغيرة متكررة من الحمض النووي توجد في جميع أنحاء الجينوم. يمكن أن يتغير حجم ساتل المجهري بسبب إخفاقات في آلية إصلاح تطابق الحمض النووي.
تقليديًا، يتم الكشف عن MSI من خلال مقارنة مناطق الساتل في الأنسجة الورمية والطبيعية عبر PCR. ومع ذلك، يمكننا في CEGAT التنبؤ بحالة MSI عبر NGS. تم التحقق من صحة هذه التقنية مع مئات من أزواج العينات الطبيعية والورمية عبر أنواع مختلفة من السرطان، حيث تم اختبار أكثر من 2,500 نقطة ساتل المجهري مستهدفة.
HRD – نقص إعادة التركيب المتجانس
تضمن الخلايا السليمة جينوم مستقر وخاليًا من الأخطاء باستخدام آليات إصلاح الحمض النووي المختلفة. يُعتبر إصلاح التأشيب المتماثل (HR) مسارًا لإصلاح الحمض النووي يعمل على كسور الحمض النووي مزدوجة الجديلة. في حالة وجود نقص في التأشيب المتماثل (HRD)، يكون هذا المسار معيبًا بحيث يمكن أن تتراكم الطفرات والشذوذات الكروموسومية والأخطاء الأخرى في الجينوم. من خلال عدم الاستقرار الجينومي الناتج، يسهل HRD تطور الأورام وقد ثبت أنه يلعب دورًا في أنواع مختلفة من السرطان، وأبرزها في أورام الثدي والمبيض.
يمكن للجينات التي تفقد وظيفتها والمتورطة في هذا المسار أن تجعل الأورام حساسة لمثبطات PARP والعلاج الكيميائي القائم على البلاتين، حيث تستهدف هذه العلاجات تدمير الخلايا السرطانية من خلال العمل بالتنسيق مع HRD عبر القتل الاصطناعي. لتحديد الأورام التي تكون فيها هذه الأدوية قابلة للتطبيق، يُعد تحديد حالة HRD بدقة أمرًا بالغ الأهمية.
تُسبب الأورام التي تعاني من نقص التأشيب المتماثل غالبًا طفرات جرثومية أو جسمية في BRCA1 أو BRCA2. لذلك، كان يشار إلى هذا النمط سابقًا بـ BRCAness. بالإضافة إلى ذلك، ثبت أن الطفرات في جينات HR الأخرى مثل RAD51C و ATM و PALB2 تسبب HRD. يجب الإشارة إلى أن ليس كل خلل جيني في جينات HR يؤدي بالضرورة إلى HRD في الورم. على العكس، يمكن أن يحدث HRD دون وجود طفرة جينية يمكن اكتشافها في جينات HR، مثل مثيلة المحفز لجينات BRCAness. لذلك، إذا حاول المرء اكتشاف الطفرات فقط في جينات BRCAness، فقد يبقى HRD المحتمل غير مكتشف. لضمان عدم تجاهل الأورام التي تعاني من نقص التأشيب المتماثل، نحسب درجة HRD كجزء من كل تحليل CancerPrecision® بغض النظر عن نوع الورم.
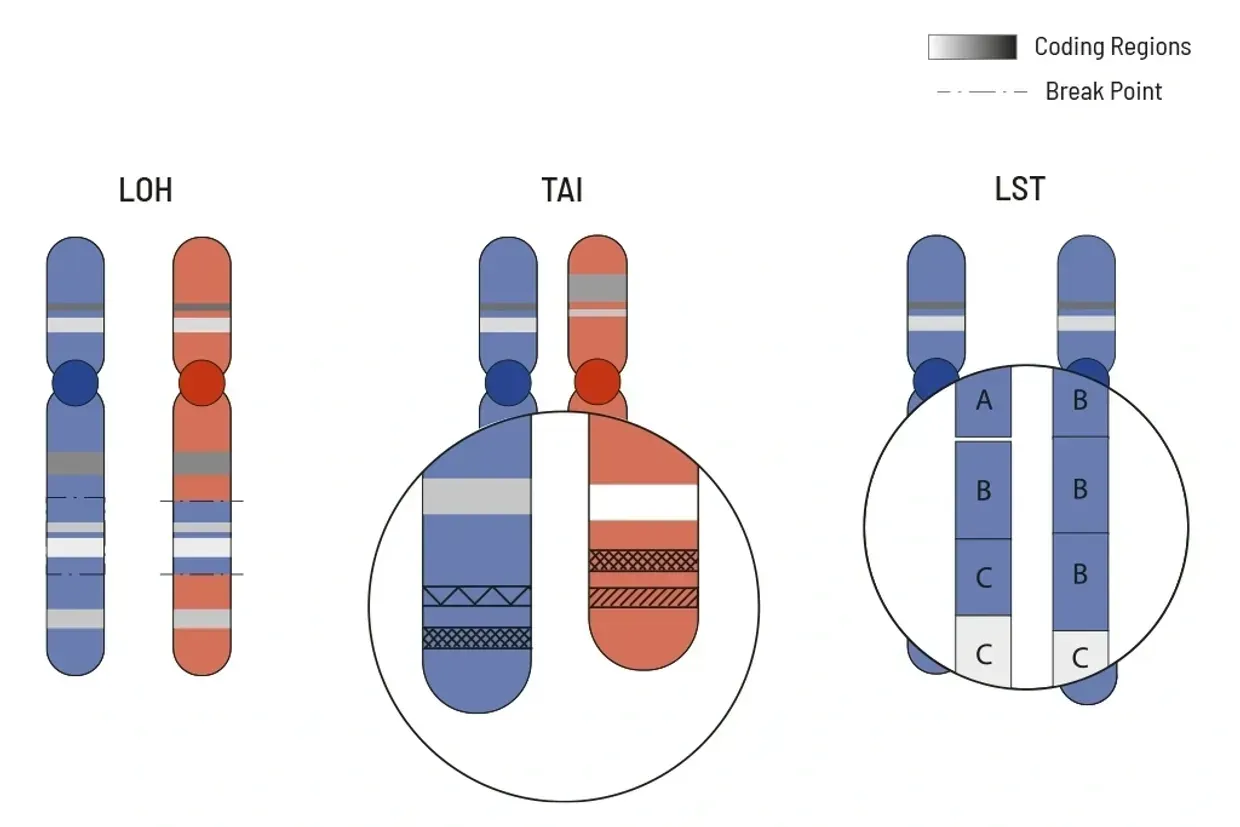
تقيس درجة HRD عدم الاستقرار الجينومي الكلي بناءً على عدد الإضافات، الاستبدالات وإعادة الترتيب التي تحدث على مستوى الجينوم بالكامل. لا يتعين تحديد الطفرات المسؤولة بدقة لهذا. لحساب درجة HRD لعينة الورم، يُستخدم نمط الطفرات ويتم حسابه من ثلاث أحداث نموذجية لـ HRD:
- فقدان التغاير الوراثي (LOH)
- التحول على نطاق واسع (LST)
- عدم التوازن الأليلي التيلوميري (أشكال بدليه للجين) (TAI)
يتم الإبلاغ عن درجة HRD في تقرير التشخيص CancerPrecision® لدينا مع أي طفرات جسدية محددة وإندماجيات جينية مختارة بالإضافة إلى TMB و MSI و CNVs لتوفير تحليل شامل للأورام.
تحليل CNV
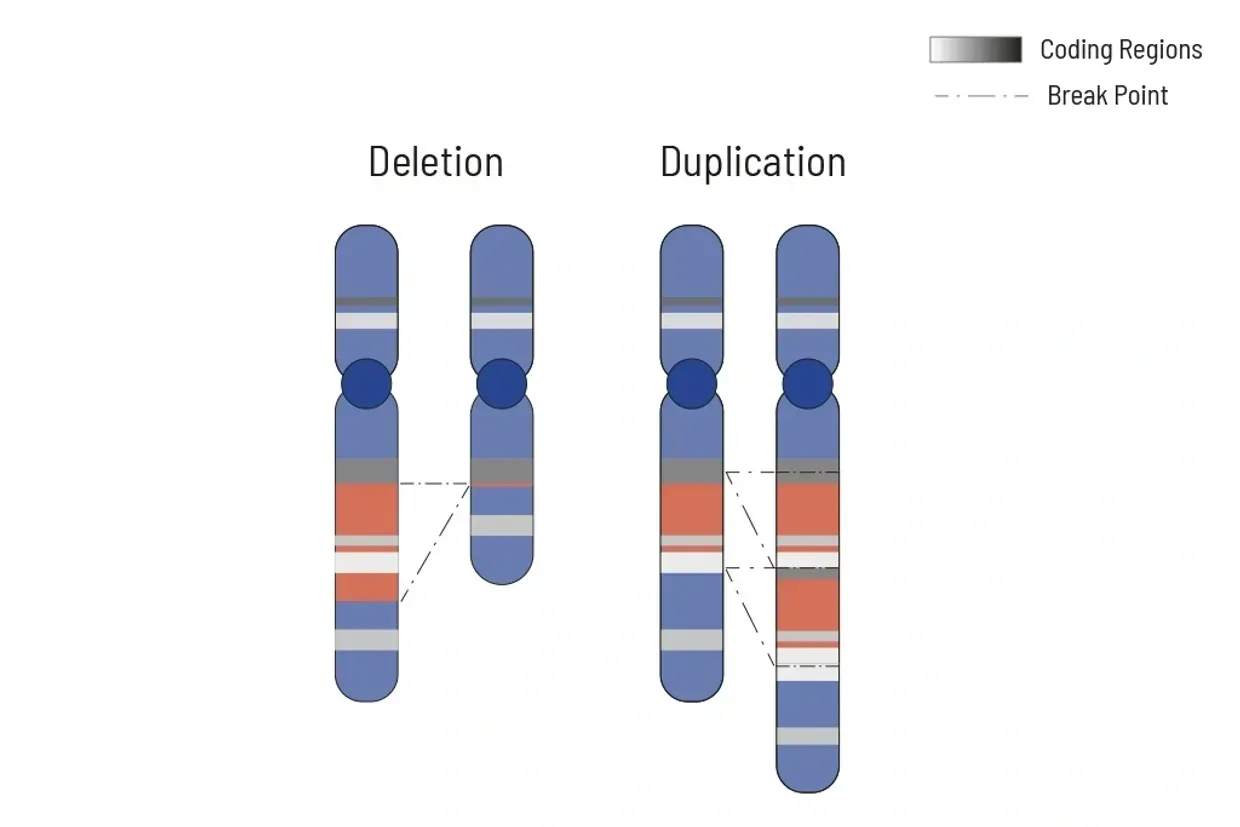
تحديد الحذف/التضخيم لتحقيق أعلى فائدة علاجية
تلعب التباينات في عدد النسخ (CNVs) غالبًا دورًا مهمًا في جينات الأورام. معرفة التغيرات في CNVs تساعد في اختيار العلاج الأمثل. لذلك، يُعتبر تحليل CNV جزءًا لا يتجزأ من تشخيص الأورام الجسدية لدينا.
تتم تنظيم العمليات الخلوية بشكل محكم، وتعتمد هذه التنظيمات على الوظيفة الصحيحة للجينات. في الأورام، يتغير عدد نسخ الجينات بشكل متكرر، مما يعيق الوظيفة الصحيحة للجينات المتأثرة. يمكن لزيادة عدد نسخ الجين أن تزيد من نشاطه، في حين أن الحذف (الجزئي) يمكن أن يؤدي إلى فقدان الوظيفة. لذلك، يمكن أن يكون للشذوذات الكروموسومية التي تؤدي إلى تغييرات في عدد النسخ عواقب علاجية.
في الأورام، تكون CNVs شائعة نظرًا لعدم الاستقرار الجينومي العام. هنا، غالبًا ما تُحذف أو تُضخم أجزاء كبيرة من الكروموسومات. فهم هذه المحذوفات/التضخمات ومعرفة الجينات في المنطقة المتأثرة ذات الصلة العلاجية هو أمر مهم. لذلك، يتم اكتشاف المحذوفات والتضخمات استنادًا إلى بيانات NGS المستخلصة.
تُدرج المحذوفات والتضخمات مع الجينات المتأثرة ذات الصلة العلاجية في بداية التقرير. ويُظهر الملحق في التقرير ملف CNV الكامل للمناطق المحللة.
®CANCERFUSIONRX
تحديد اندماجيات الجينات استنادًا إلى RNA
تحدث إعادة ترتيب الكروموسومات بشكل متكرر في جميع أنواع السرطان. نتيجة لذلك، يمكن أن تحدث اندماجيات الجينات في جينوم السرطان. تُعتبر الاندماجيات محركات رئيسية للسرطان، وبالتالي فهي ذات صلة كبيرة لاتخاذ القرارات العلاجية. لن تكتشف الطرق التقليدية المستندة إلى PCR اندماجًا عندما لا يُعرف الشريك الآخر (غالبًا ذات صلة بالاندماجيات في تيروزين كيناز العصبي، NTRK). حتى التحليلات الشاملة للنسخوم ليست حساسة بما يكفي، خاصة عندما يكون محتوى الورم منخفضًا.
لاكتشاف جميع الاندماجيات الجينية المعروفة والموصوفة سابقًا وكذلك الجديدة مع الخيار العلاجي، قمنا بتطوير إثراء مستهدف من الجيل التالي يعتمد على RNA. يشمل التصميم حاليًا أكثر من 150 جينًا لاكتشاف الاندماج وأكثر من 120 إثراءً مخصصًا الإكسون بنقاط الانكسار المعروفة. هذه الطريقة تتفوق على الطرق المستندة إلى DNA وأيضًا على الأساليب المستندة إلى RNA بالكامل. نوصي بشدة بإكمال التشخيص الورمي الجيني من خلال إثراء RNA للاندماجيات للحصول على فهم كامل لبيولوجيا الورم.
تحميلات
CeGaT CancerPrecision Sample Report (pdf)
